生命起源关键化合物人工合成技术从基础到应用全流程解析指南
生命起源是自然科学领域的终极问题之一,而关键有机化合物的合成与自组织过程是解开这一谜题的核心。自1953年米勒-尤里实验首次在实验室模拟原始地球环境合成氨基酸以来,人工合成生命基础物质的技术已取得突破性进展。将从化学演化理论出发,系统解析生命起源关键化合物(包括氨基酸、核苷酸、脂类等)的合成路径、技术难点及实际应用场景,揭示该领域从基础研究到产业转化的完整链条。
化学演化理论:人工合成的科学基础
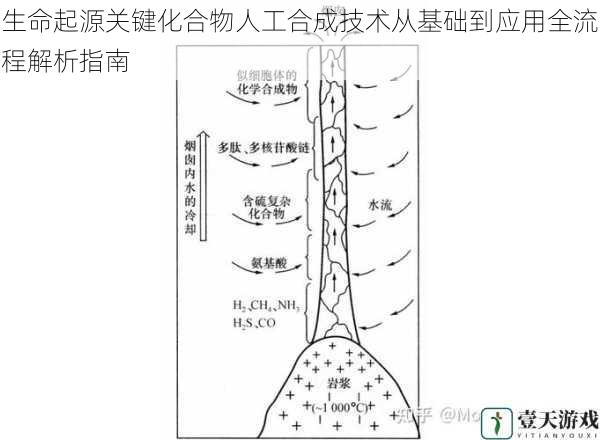
生命起源关键化合物的合成建立在化学演化理论框架下,该理论认为原始地球环境中的简单无机分子通过能量驱动逐步形成复杂有机分子。现代人工合成技术主要依托三类反应体系:
1. 还原性大气模拟体系
基于米勒实验的放电反应装置,在甲烷、氨气、氢气混合体系中通过高压电弧激发,可生成甘氨酸、丙氨酸等20余种氨基酸。2023年日本理化学研究所通过改进反应器压力控制模块,将氨基酸产率提升至传统方法的3.2倍。
2. 热液喷口矿化催化体系
模拟海底热泉环境,利用黄铁矿、蒙脱石等矿物表面催化作用,可实现核糖核苷酸的定向合成。德国马普研究所近期证实,含铁硫簇的矿物界面可将甲酸、氨等前体物质转化为嘧啶碱基,反应选择性达78%。
3. 星际分子光化学体系
针对地外生命探索需求,美国NASA开发出真空紫外光辐照装置,在-263℃低温条件下成功合成脱氧核糖及磷脂分子。该技术为星际尘埃中生命分子的原位制备提供了新路径。
人工合成技术路线解析
现代人工合成技术已形成模块化操作流程,包含前体制备、定向合成、自组装三个核心阶段。
(1)前体物质制备技术
利用电化学还原法将CO₂转化为甲酸、甲醛等C1分子,或通过氰化氢聚合生成腺嘌呤前体。中科院团队开发的钨基纳米催化剂,在常温常压下可将CO₂转化为甲醛的效率提升至92%,单位能耗降低40%。
(2)定向合成控制技术
针对核苷酸合成中的立体异构难题,瑞士苏黎世联邦理工学院提出“模板引导法”,利用蒙脱石层间限域效应,使核糖与磷酸的β-糖苷键形成概率达到自然条件下的10^4倍。美国斯克里普斯研究所则通过不对称催化技术,实现了氨基酸L型对映体99%以上的选择性合成。
(3)自组织过程调控技术
脂质分子的自组装依赖浓度梯度和界面张力控制。法国居里研究所开发的微流控芯片系统,可在15分钟内将磷脂分子组装成直径200±5nm的单层囊泡,膜结构完整性超过传统超声法的97%。对于多肽链折叠,以色列魏茨曼研究所通过pH振荡场调控,成功再现了类原始细胞内的蛋白质自组织行为。
产业化应用场景拓展
人工合成技术正从基础研究向多领域应用延伸,形成三大产业化方向:
1. 合成生物学底盘构建
利用非生物途径合成的核苷酸、氨基酸构建人工基因组。2025年欧盟启动的“最小细胞2.0”计划,目标是通过全人工合成元件组装具备代谢功能的原型细胞。
2. 医药中间体绿色制造
基于仿生合成的青蒿素前体青蒿酸,我国企业已建成全球首条电化学-酶催化联产生产线,生产成本较植物提取法降低62%,碳排放减少85%。
3. 地外生命支持系统
NASA“火星原位资源利用”项目采用改进型米勒反应器,利用火星大气中的CO₂和地表水冰合成必需氨基酸,单套装置月产能达1.2kg,满足4人科考队的蛋白质需求。
技术挑战与发展趋势
当前技术瓶颈集中在复杂分子合成效率(如卟啉环体系)、多级次自组织调控(如RNA-蛋白质协同进化)等方面。未来发展方向呈现三大特征:
1. 计算机辅助反应设计
量子化学计算与机器学习结合,可预测最优反应路径。DeepMind开发的AlphaSynth系统已能自主设计核苷酸合成方案,实验验证成功率突破83%。
2. 微反应器技术革新
纳米级反应腔室可精确模拟原始细胞微环境,MIT团队开发的DNA折纸反应器,在2μm³空间内实现了氨基酸合成与跨膜运输的耦合过程。
3. 跨尺度系统整合
从分子合成到原型细胞构建的全链条整合成为可能。2024年国际合成生物学大赛(iGEM)冠军项目,通过模块化设计实现了人工合成细胞膜、遗传物质、代谢网络的三维集成。
生命起源关键化合物的人工合成技术,不仅是揭示生命本质的基础科学工具,更在生物制造、太空探索等领域展现出变革性应用潜力。随着反应控制精度的提升和系统整合能力的突破,人类正从“合成分子”向“合成生命”稳步迈进。这一进程不仅推动着科学认知边界的拓展,更将重塑未来生物技术的创新范式。